导读聚焦
本期导读汇聚了多项肿瘤代谢研究,从多角度展现了代谢过程如何影响肿瘤的发生、发展和干预机制:
1. 活性内源性代谢物
色氨酸途径的犬尿氨酸(Kyn)促进头颈部鳞状细胞癌HNSCC的增殖和转移(Cancer Communications);中枢代谢物N-乙酰天冬氨酸(NAA)在耐药肿瘤中过表达,肿瘤细胞通过模仿中枢神经系统的抗炎机制来逃避抗肿瘤免疫(Cancer Cell);牛磺胆酸通过诱导髓源性抑制细胞的积累来加速癌症转移(Cell Metabolism)。
2. 线粒体代谢
MYG1通过其在细胞核和线粒体中的协同作用促进结直肠癌的糖酵解和肿瘤进展(Nature Communications);在肿瘤研究之外,肝脏再生过程中,肝脏利用其代谢的不灵活性,通过脂质积累,抑制线粒体电子传递链ETC功能障碍的肝细胞的增殖,以保护肝脏健康(Science)。
导读目录
1. Cancer Communications | 头颈部鳞状细胞癌的代谢景观揭示kynurenine/Siglec-15作为一种新的免疫逃逸机制
2. Cell Metabolism | 失调的生物钟通过肠道微生物群引起髓源性抑制细胞的积累来加速癌症转移
3. Science | 线粒体代谢的不灵活性保护再生肝脏健康
4. Nature Chemical Biology | 肿瘤再生细胞通过PCK2依赖的磷脂重塑逃避铁死亡
5. Cancer Cell | 肿瘤细胞通过中枢神经系统富集代谢物促进免疫突触形成
6. Immunity | 禁食可改善NK细胞介导的抗肿瘤免疫
7. Cell Metabolism | 致癌脂肪酸氧化对睡眠不足患者昼夜节律的影响
8. Nature Communications | MYG1通过核-线粒体协作驱动糖酵解和结直肠癌的发展
资源领取
本期导读文献原文,请在公众号后台回复“2024年6月绘谱导读”,即可获取资源链接。
01
Cancer Communications | 头颈部鳞状细胞癌的代谢景观揭示kynurenine/Siglec-15作为一种新的免疫逃逸机制

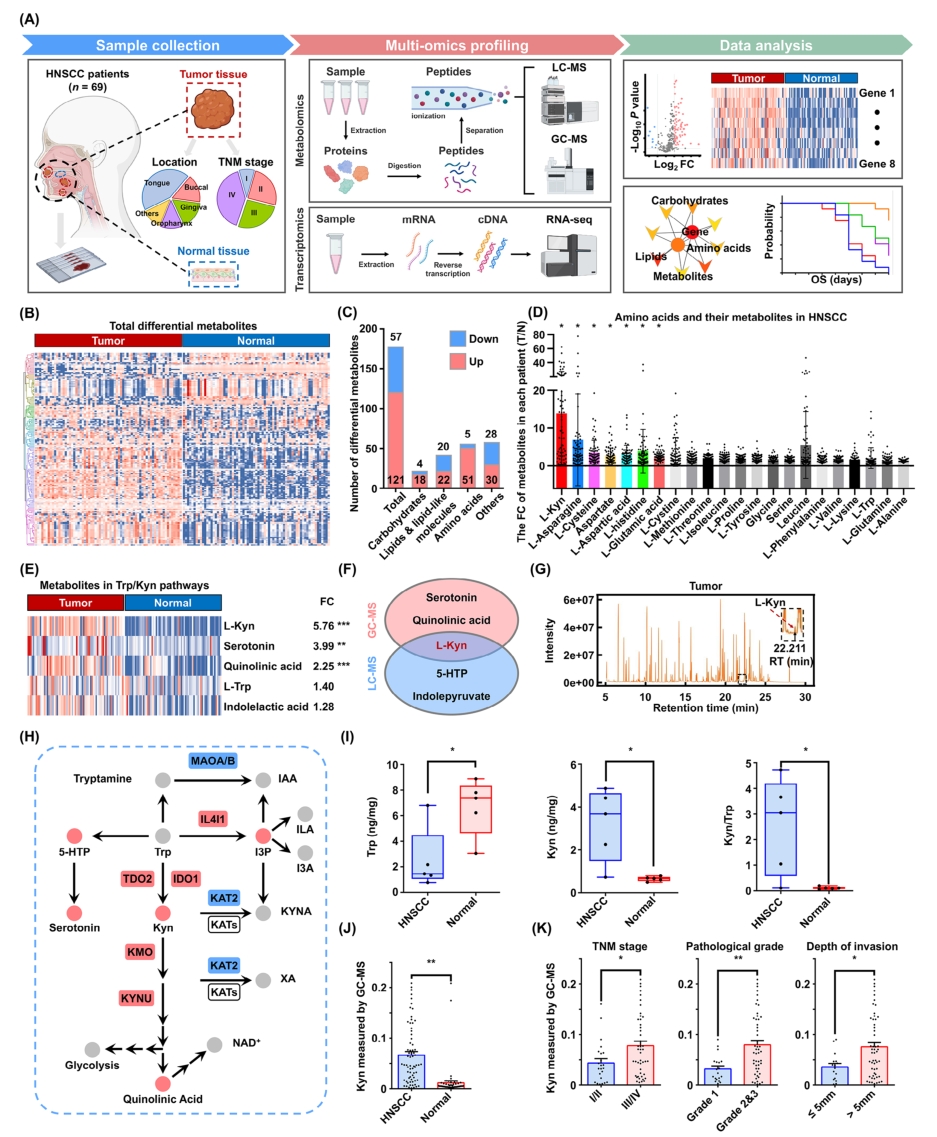
代谢重编程和免疫逃逸是癌症的两个标志,代谢紊乱如何在头颈部鳞状细胞癌(HNSCC)中驱动免疫逃逸尚不清楚。因此本研究的目的是探讨HNSCC的代谢景观及其驱动免疫逃逸的机制。
1. 对69例HNSCC患者的肿瘤组织以及邻近正常组织进行气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)检测分析。结果表明,氨基酸是主要的差异代谢物类别,并且甘氨酸、丝氨酸、苏氨酸和色氨酸等几种氨基酸途径显著富集。在HNSCC患者肿瘤组织中,参与色氨酸途径的犬尿氨酸(Kyn)含量增加,且倍数差异变化最显著。ROC分析结果证明Kyn对HNSCC有很好的诊断效能。
2. 体外和体内研究表明Kyn促进了HNSCC的增殖和转移。肿瘤来源的Kyn被转移到CD8+T细胞中,诱导T细胞功能衰竭,阻断Kyn转运体恢复其杀伤活性。小鼠体内靶向芳香烃受体(AhR)可降低Kyn介导的免疫抑制性受体Siglec-15表达,促进肿瘤内CD8+T细胞浸润和杀伤能力。
3. 设计了创新的纳米颗粒载体来递送Siglec-15小干扰RNA(siS15),靶向siglece -15可以显著提高PD-1抗体的治疗效果,从而为后续的临床治疗提供了新的治疗策略。
4. 在HNSCC患者队列中发现siglece-15与HNSCC组织中AhR表达及CD8+PD-1+T细胞浸润呈正相关。
参考文献
Zhang XY, et al. Metabolic landscape of head and neck squamous cell carcinoma informs a novel kynurenine/Siglec-15 axis in immune escape. Cancer Commun (Lond). 2024
02
Cell Metabolism | 失调的生物钟通过肠道微生物群引起髓源性抑制细胞的积累来加速癌症转移

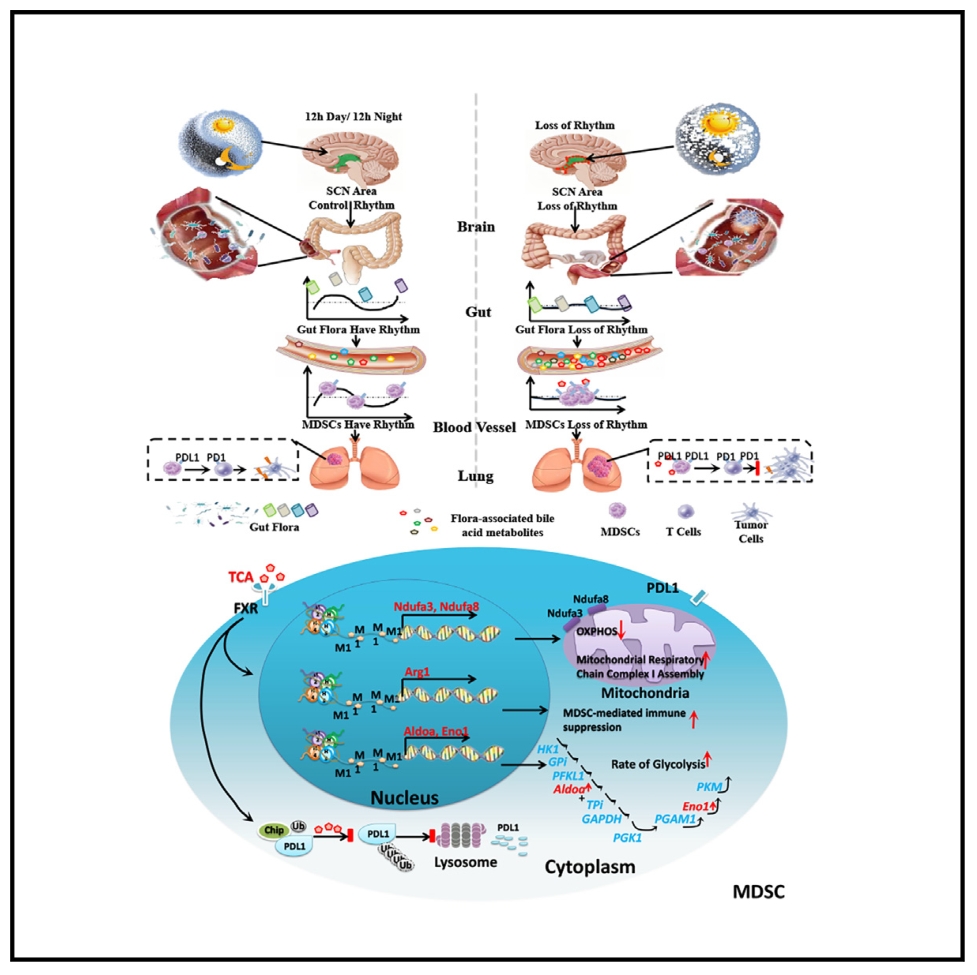
髓源性抑制细胞(MDSCs)不仅可以直接促进免疫逃逸,还可以帮助肿瘤侵袭。生物节律平衡是哺乳动物应对外部环境的关键内在机制,生物节律异常与许多疾病密切相关。然而,MDSCs、昼夜节律与肿瘤微环境(TME)之间的相互作用及对癌症转移的影响尚不清楚。本研究将中枢神经系统中的中枢时钟与肿瘤环境中的MDSCs联系起来,通过肠道微生物群及其衍生代谢物控制结直肠癌的转移扩散,揭示了癌症转移的内在机制。
1. 连续4.5天定时监测148例无远端转移的结直肠癌(CRC)患者、115例有远端转移的CRC患者和80例肺癌患者的体温变化,结果表明无远端转移CRC患者体温波动表现出明显的昼夜节律,而发生远处转移CRC患者和肺癌患者体温波动无节律性。
2. 构建多种节律紊乱小鼠模型,发现昼夜节律紊乱可诱导小鼠肺中MDSCs和功能失调的CD8+T细胞的积累,促进结直肠癌的肺转移。
3. 16S DNA和宏基因组测序结果表明,节律紊乱小鼠的肠道菌群失调会诱导MDSCs在肺部的积累,促进了CRC的肺部转移。
4. 非靶代谢组学和胆汁酸代谢组学分析表明,节律紊乱小鼠牛磺酸胆酸(TCA)丰度高于对照小鼠。在抗生素治疗后,节律紊乱小鼠的结直肠癌肺转移明显减轻,但给予TCA会导致CRC肺转移加重。进一步检测临床转移性CRC患者血清TCA水平,发现其水平显著高于无转移CRC患者和健康个体。
5. 体外实验结果表明,TCA通过增强靶基因H3K4的单甲基化,在表观遗传层面促进MDSCs的免疫抑制功能和糖酵解,并在蛋白质水平上抑制E3泛素连接酶(CHIP)介导的 PDL1泛素化。
参考文献
Liu JL, et al. Dysfunctional circadian clock accelerates cancer metastasis by intestinal microbiota triggering accumulation of myeloid-derived suppressor cells. Cell Metab. 2024
03
Science | 线粒体代谢的不灵活性保护再生肝脏健康

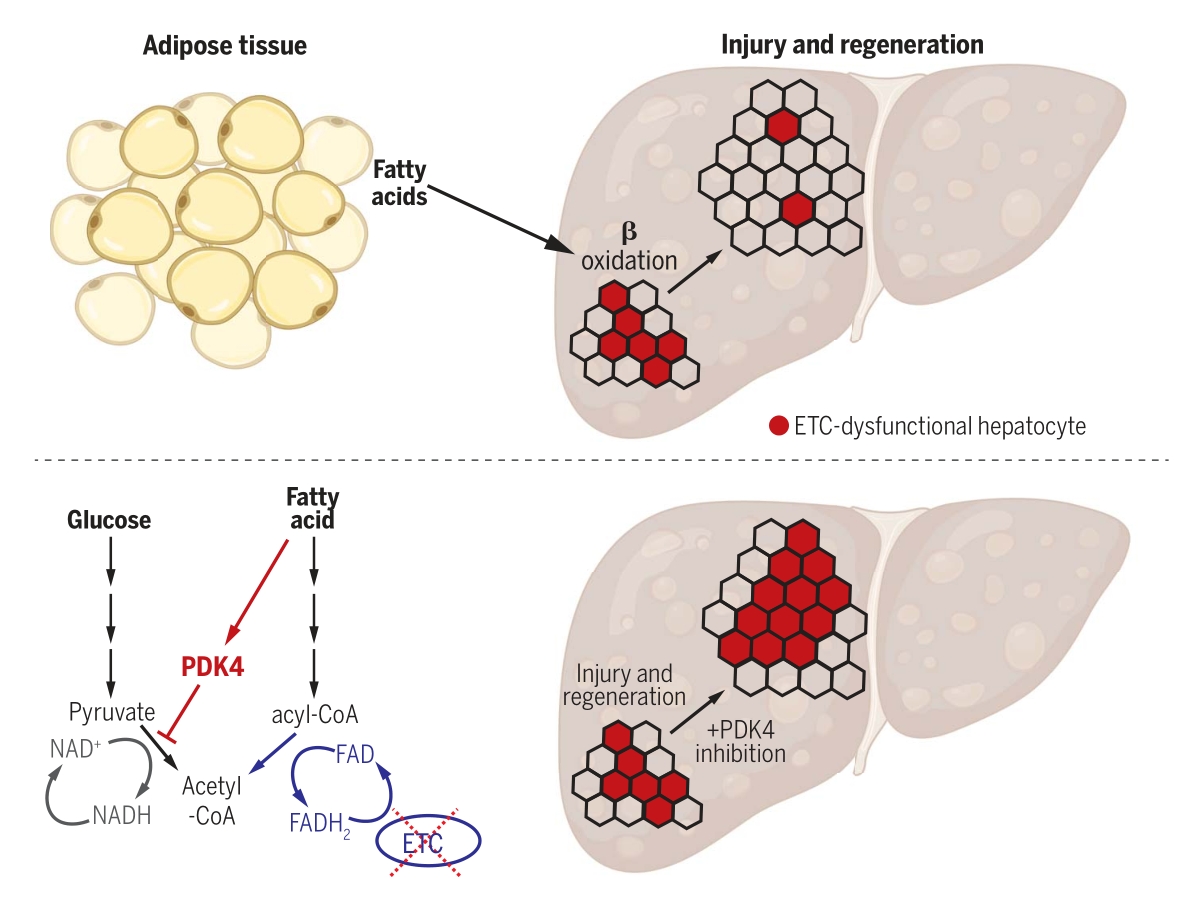
线粒体电子传递链(ETC)功能障碍常见于获得性人类疾病,包括代谢相关的肝脏疾病。在肝再生过程中,增殖的肝细胞竞争并允许适应性增加的细胞更容易对再生器官的组成做出贡献。本研究通过线粒体代谢谱和同位素示踪技术研究了肝细胞在稳态和再生条件下的代谢反应,发现电子传输链(ETC)功能障碍的肝细胞的增殖受到抑制,这种代谢不灵活性可以被小鼠肝脏用来促进增殖细胞群体的整体健康。
1. 线粒体代谢组检测显示,在肝脏再生过程中脂肪酸和酮体的水平增加,且不同区域线粒体的脂肪酸与酮体的上调比例与区域再生能力呈现正相关。此外,在肝脏再生过程中,利用[U-13C]棕榈酸同位素示踪(代谢流),检测到大量M+2的β羟基丁酸及带有标记的TCA循环产物,此外还观察到显著增加的M+2乙酰辅酶A。以上结果提示,在肝脏再生过程中其脂肪代谢能力上升。
2. 分别构建线粒体复合物Ⅰ~Ⅴ等位基因限制性敲除的小鼠模型,结果发现在经过肝脏切除术后仅有敲除Ndufa9(复合物Ⅰ)和Cox10(复合物Ⅴ)的小鼠存活,但后者的肝脏无法再生,且发生脂肪堆积。
3. 进一步对Cox10敲除小鼠的肝脏进行代谢组检测和CHIP-seq,发现乙酰辅酶A及组蛋白乙酰化水平下降,导致与细胞周期有关的基因表达下降,进而影响肝脏再生;此外,通过[U-13C]葡萄糖及[U-13C]乙酸钠同位素示踪(代谢流),发现在电子传递链功能障碍的背景下,脂肪酸的积累通过抑制丙酮酸脱氢酶激酶4(PDK4)的表达,阻止了丙酮酸向乙酰辅酶A的转化,进一步加剧了代谢不灵活性。
参考文献
Wang X, Menezes CJ, Jia Y, et al. Metabolic inflexibility promotes mitochondrial health during liver regeneration. Science. 2024.
04
Nature Chemical Biology | 肿瘤再生细胞通过PCK2依赖的磷脂重塑逃避铁死亡

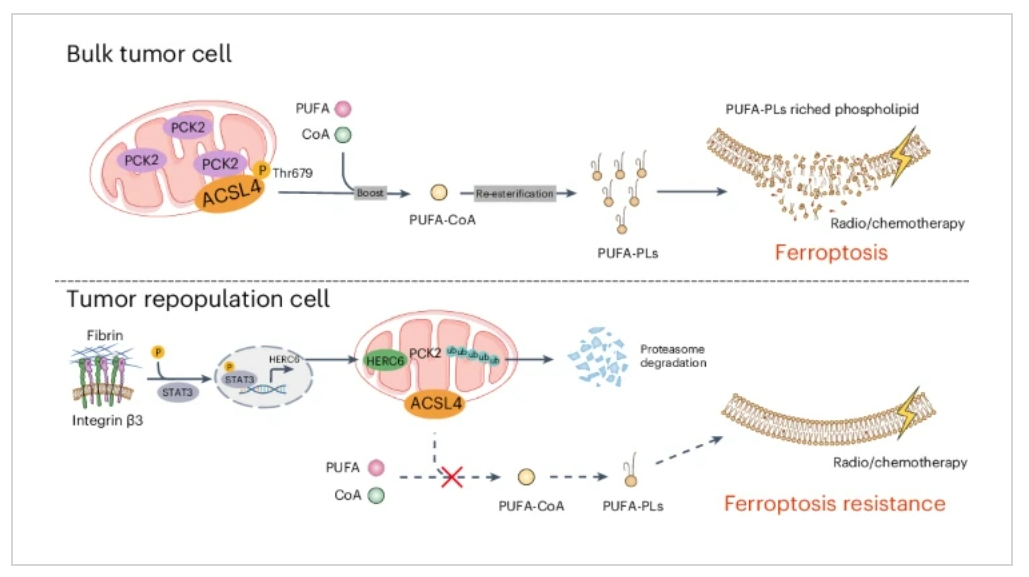
肿瘤干细胞是一类可自我更新、具有高度致瘤性的癌细胞亚群,对各种抗癌治疗具有抗性;铁死亡是一种铁依赖的、以膜磷脂多不饱和脂肪酸链过氧化为核心的细胞死亡方式。然而,肿瘤干细胞是否通过耐受铁死亡来介导放疗抵抗尚不清楚。本研究通过定量质谱检测、脂质组学、氧化还原脂质组学及基因编辑等技术,阐释了肿瘤再生细胞通过重塑膜磷脂耐受铁死亡进而抵抗肿瘤放化疗的机制,揭示了线粒体及线粒体代谢酶PCK2在调控肿瘤细胞ACSL4相关磷脂重塑中的关键作用。
1. 研究首先通过3D纤维软胶培养模型筛选和富集了具有干性特征的肿瘤再生细胞(TRCs)。氧化还原脂质组学分析发现,这类肿瘤再生细胞可通过降低铁死亡敏感性来逃避放疗。
2. 随后通过脂质组学分析发现TRCs的PUFA-PLs显著降低,进一步筛选聚焦长链脂酰CoA合成酶ACSL4。磷酸化蛋白质组学、分子动力学模拟结合3种底物与ACSL4的结合实验揭示了T679号位点的磷酸化对于维持ACSL4酶活性至关重要,并决定了细胞对铁死亡的敏感性。
3. 试图寻找调节ACSL4 T679磷酸化的关键激酶或磷酸酶。定量质谱分析筛选出一种参与糖异生的激酶PCK2,siRNA 转染、免疫荧光、细胞组分分析、免疫共沉淀、WB和体外激酶试验均证明了PCK2可以直接磷酸化ACSL4。
4. 最后确定调节PCK2表达的转录因子。SiRNA转染发现仅敲低STAT3可消除TRC中的PCK2下调,泛素化蛋白质检测发现TRC中PCK2的泛素化水平增加。转录组测序、免疫沉淀和免疫印迹分析等结果证实,转录因子STAT3的激活在调节PCK2表达中至关重要,因此导致TRC对铁死亡敏感性降低。
参考文献
Li Z, Xu ZM, Chen WP, et al. Tumor-repopulating cells evade ferroptosis via PCK2-dependent phospholipid remodeling. Nat Chem Biol. 2024.
05
Cancer Cell | 肿瘤细胞通过中枢神经系统富集代谢物促进免疫突触形成

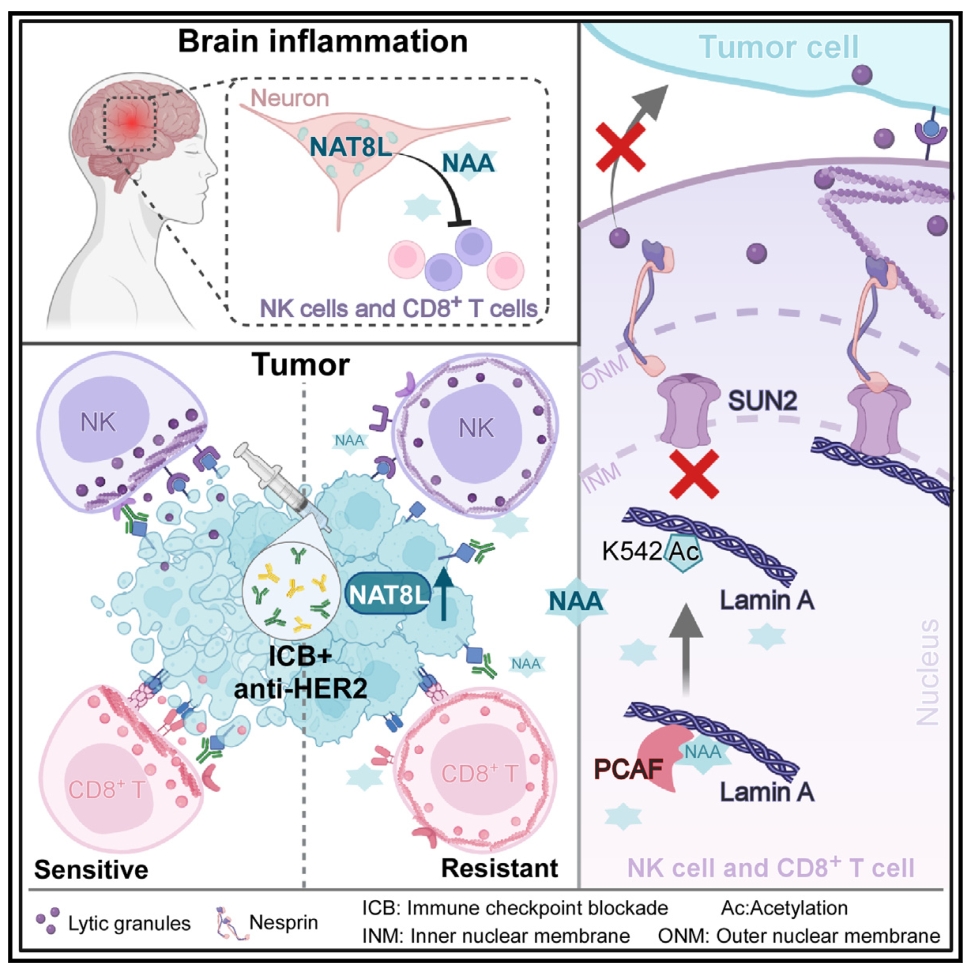
肿瘤细胞为了生存,通常会采用各种策略来逃避免疫监视。中枢神经系统(CNS)具有多种抑制免疫反应的功能。目前肿瘤和中枢神经系统是否有相似的免疫抑制机制尚不清楚。本研究通过多组学数据发现CNS富集的N-乙酰转移酶8样蛋白(NAT8L)及其代谢物N-乙酰天冬氨酸(NAA)在耐药肿瘤中过表达,肿瘤细胞通过模仿中枢神经系统的抗炎机制来逃避抗肿瘤免疫,NAT8L和NAA是增强抗癌药物疗效的潜在靶点。
1. 通过代谢组学分析表明,在耐药肿瘤中,最显著的代谢途径是丙氨酸、天冬氨酸和谷氨酸代谢,其中N-乙酰天冬氨酸(NAA)、N-乙酰天冬氨酸谷氨酸(NAAG)和天冬氨酸(NAA的主要前体)含量较高。转录组学数据进一步表明,N-乙酰转移酶8样蛋白(NAT8L),即NAA的合成酶,是耐药肿瘤样本中上调最多的基因之一。
2. 使用药物亲和反应靶标稳定性(DARTS)方法对未经NAA处理和经NAA处理的NK细胞的细胞裂解物进行蛋白质组学分析,发现lamin A蛋白是73种NAA结合候选蛋白中最富集的蛋白之一。
3. 通过western blotting和液相色谱-串联质谱(LC-MS/MS)验证了NAA处理的NK细胞和CD8+T细胞中lamin A-K542的乙酰化,进一步研究发现NK细胞和CD8+T细胞中K542乙酰化的lamin A蛋白的水平与肿瘤组织中NAT8L的水平呈正相关。
参考文献
Li Y, Huang M, Wang M, et al. Tumor cells impair immunological synapse formation via central nervous system-enriched metabolite. Cancer Cell. 2024.
06
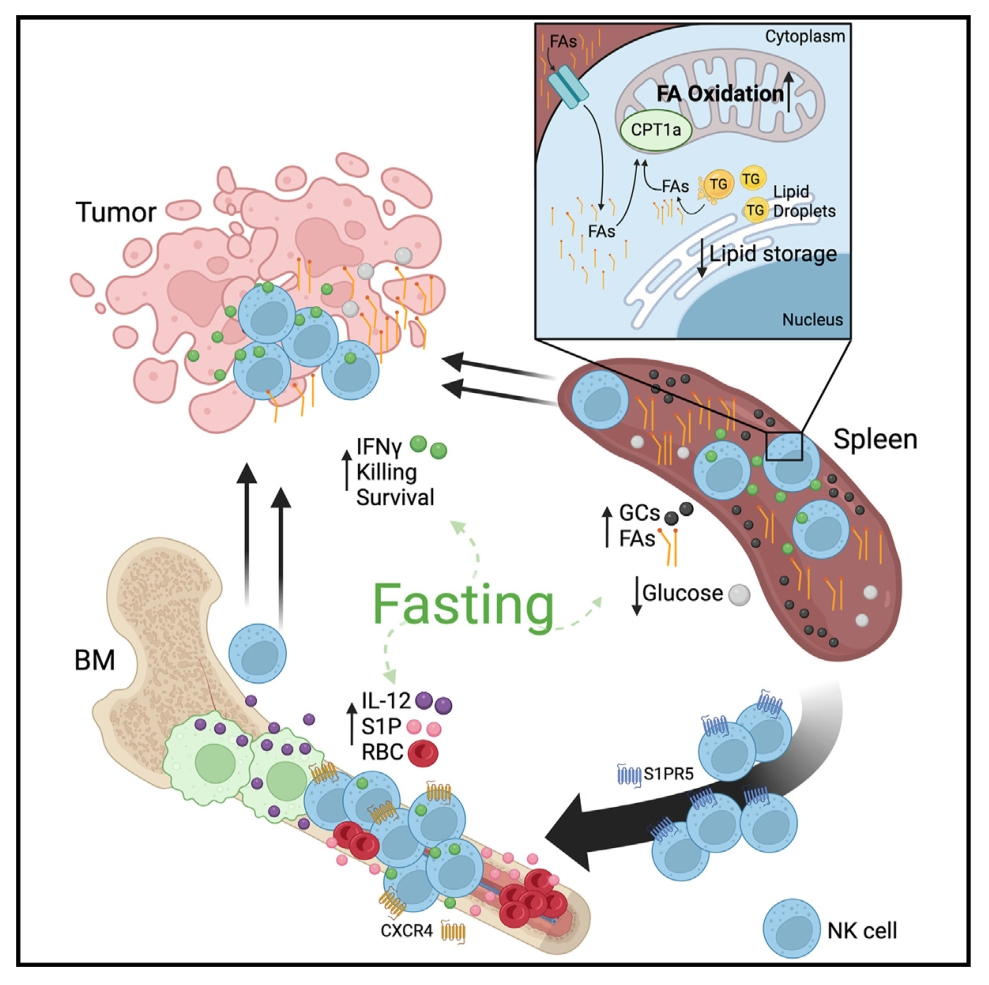
Immunity | 禁食可改善NK细胞介导的抗肿瘤免疫

自然杀伤细胞(NK)是循环的细胞毒性淋巴细胞,在宿主对抗癌症的免疫中起关键作用。禁食与改善癌症预后有关。本研究发现禁食小鼠脾脏中的NK细胞通过脂肪酸和糖皮质激素浓度的升高进行代谢重组,通过增加Cpt1a酶的表达来增加脂肪酸代谢,Cpt1a的缺失会损害NK细胞的存活和功能。本研究揭示了饮食限制和优化的先天免疫反应之间的联系,有可能提高免疫疗法的效果。
1. 对随意饮食和禁食小鼠的NK细胞和总CD8+T细胞进行了全面的细胞能量代谢分析,结果显示,两种细胞的糖酵解能力都出现了显著下降,仅在禁食的小鼠NK细胞中观察到了OXPHOS(氧化磷酸化)能力的维持。
2. 使用单细胞RNA测序(scRNA-seq)技术对控制饮食(CFD)和自由饮食小鼠的NK细胞进行分析,结果发现在CFD组NK细胞中脂肪酸代谢基因呈现上调的趋势。进一步研究发现,参与脂肪酸代谢的关键酶编码基因,如Cpt1a,其表达量增加;同时,与糖酵解过程相关的基因Ldha的表达量减少。
3. 将成熟的CD45.1表达的脾脏NK细胞转移到CD45.2表达的受体小鼠中,发现禁食后脾脏和血液中的NK细胞数量减少,骨髓中数量增加。使用iNkp46tdTomato小鼠模型,标记成熟的外周NK细胞,发现禁食期间NK细胞重新分布到骨髓中。
参考文献
Delconte RB, Owyong M, Santosa EK, et al. Fasting reshapes tissue-specific niches to improve NK cell-mediated anti-tumor immunity. Immunity. 2024.
07
Cell Metabolism | 致癌脂肪酸氧化对睡眠不足患者昼夜节律的影响

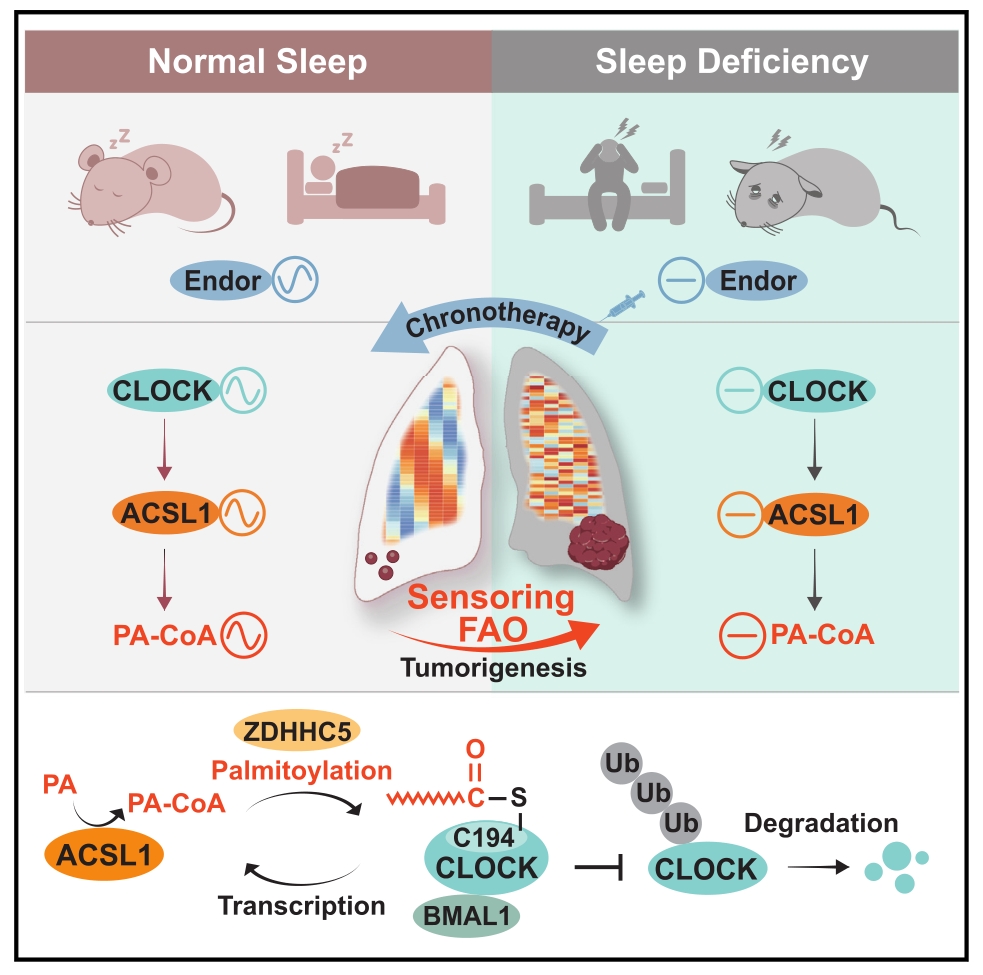
生物钟紊乱是现代生活方式的一个显著特征,睡眠不足(Sleep deficiency, SD)会破坏生物钟,触发包括免疫功能障碍、代谢紊乱等多种病理过程,改变了包括葡萄糖、谷氨酸、胆汁酸和脂质代谢在内的多种代谢过程的振荡。然而,代谢重构如何感应节律紊乱并影响SD增强的癌症发展尚不清楚。本研究通过转录组学和代谢组学分析,揭示了脂肪酸氧化(Fatty acid oxidation, FAO)作为生物钟的感应器,将SD诱导的生物钟紊乱与肺肿瘤发生的肿瘤代谢信号联系起来。
1. 将小鼠肺组织(对照组和SD处理组)进行转录组和代谢组分析。转录组结果显示,对照组的FAQ基因表现出节律模式,而SD处理组织的FAO基因显著紊乱。代谢组结果表明,SD组肺组织的振荡脂质代谢物数量显著减少。这些表明FAO在基因表达和代谢功能水平上能感知到SD诱导的昼夜节律紊乱,进一步研究证实FAO在SD增强的肺癌发生中起到关键作用。
2. 通过转录数据比较,发现ACSL1蛋白是SD诱导FAO节律紊乱从而促进肺癌发展的关键分子。进一步探索机制,发现SD导致的昼夜节律紊乱使CLOCK蛋白失调,从而引起ACSL1的过度激活,后者将PA转化为PA-CoA,PA-CoA进而刺激FAO促进肺癌肿瘤的生长。
3. 在SD条件下,对肿瘤小鼠进行给药实验,发现定时给予β-内啡肽能够重置CLOCK和ACSL1的节律表达,从而缓解SD增强的肿瘤发生,也许能作为一种潜在的肿瘤疗法。
参考文献
Peng et al., Oncogenic fatty acid oxidation senses circadian disruption in sleep-deficiency-enhanced tumorigenesis. Cell Metabolism. 2024
08
Nature Communications | MYG1通过核-线粒体协作驱动糖酵解和结直肠癌的发展

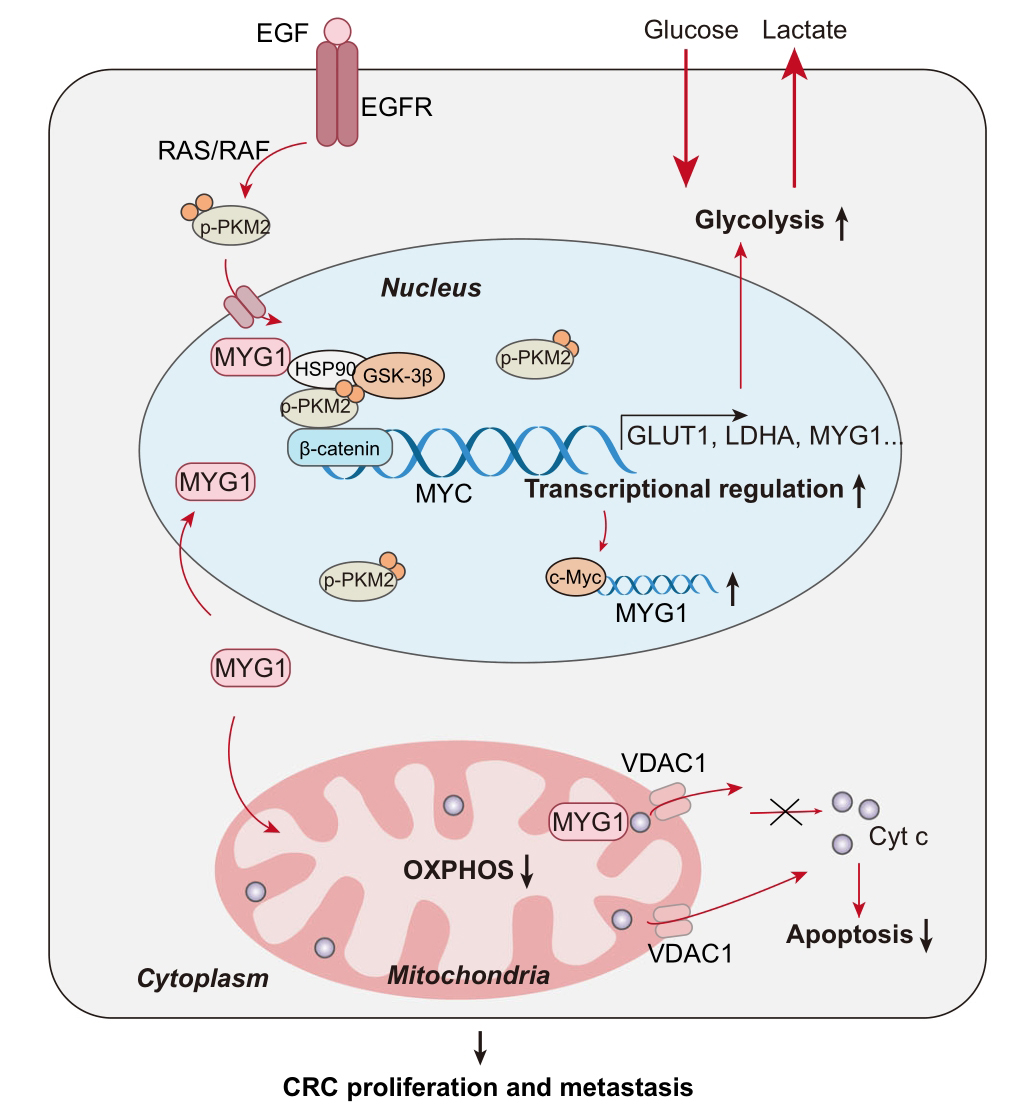
结直肠癌(Colorectal Cancer, CRC)是全球第三大常见的恶性肿瘤。肿瘤的代谢重构是其在复杂应激条件下生存的关键策略,但在结直肠癌中的分子机制尚不完全清楚。MYG1是一种3′-5′ RNA外切酶,在细胞线粒体功能中扮演重要角色。本研究旨在阐明MYG1如何通过其在细胞核和线粒体中的协同作用,独立于其外切酶活性,从而促进结直肠癌的糖酵解和肿瘤进展。
1. 通过测量MYG1在结直肠癌和配对的正常粘膜样本中的表达水平,研究发现MYG1在CRC中的表达上调,高表达的MYG1促进了糖酵解和CRC的进展,而这一作用与其外切酶活性无关。
2. MYG1在核和线粒体中均有功能。进一步研究1中的机制,发现核内的MYG1能够招募HSP90/GSK3β复合体,进而促进PKM2的磷酸化,增加其稳定性。PKM2作为一种关键的糖酵解酶,其转录激活了MYC,并推动了MYC介导的糖酵解。同时,c-Myc也能转录上调MYG1的表达,形成了一个正反馈循环,推动CRC的发展。另一方面,线粒体内的MYG1则抑制了氧化磷酸化(OXPHOS),并阻止了细胞色素C(Cyt c)从线粒体的释放,抑制了细胞凋亡。
3. 在临床层面,携带KRAS突变的CRC患者表现出MYG1的高表达,并与高水平的糖酵解和较差的预后相关。因此,针对MYG1的治疗可能扰乱CRC的代谢平衡,并为CRC的诊断和治疗提供了潜在的靶点。
参考文献
Chen, J., Duan, S., et al. MYG1 drives glycolysis and colorectal cancer development through nuclear mitochondrial collaboration. Nature Communications. 2024
END
